伴隨著全球新冠肺炎疫情進(jìn)入第三年,新冠肺炎制造的第一種口服藥物似乎即將問世在R&D第一梯隊(duì)中,君實(shí)生物VV116的頭對(duì)頭測試有望很快揭開,公司表示將爭取盡快提交境內(nèi)上市申請(qǐng),先鋒制藥表示,普羅庫胺的相關(guān)工作正在全力推進(jìn)中第一梯隊(duì)的三家公司將陸續(xù)完成相關(guān)臨床試驗(yàn)第一批或第一批國產(chǎn)新冠肺炎口服藥物會(huì)賣給哪家公司,要看臨床數(shù)據(jù)
與此同時(shí),新冠肺炎藥品的后來者還在不斷增加,加上急診審評(píng)審批政策的加持,臨床審批速度大幅提升。
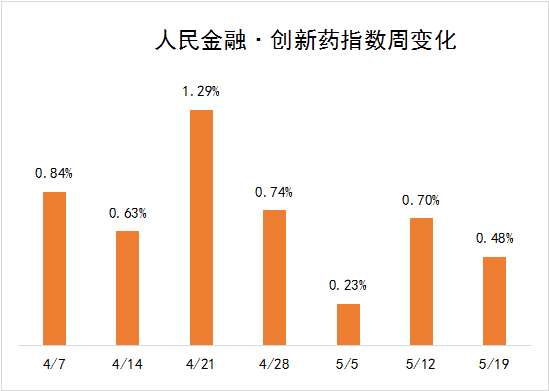
5月13日—5月19日新發(fā)布周期內(nèi),四環(huán)醫(yī)藥,全新生物,眾生藥業(yè),齊魯制藥6個(gè)創(chuàng)新藥項(xiàng)目首次獲得臨床批準(zhǔn),我們將其納入人民金融創(chuàng)新藥指標(biāo),同時(shí)推進(jìn)了先正達(dá),智翔醫(yī)藥等創(chuàng)新藥物項(xiàng)目的研發(fā)進(jìn)度在這些因素的推動(dòng)下,人民金融與創(chuàng)新藥指數(shù)在新發(fā)布周期上漲0.48%,最新報(bào)2655.99點(diǎn)
日前,《新興微生物感染》雜志發(fā)表了VV116應(yīng)對(duì)奧米克隆感染的臨床研究結(jié)果這是第一份關(guān)于用新冠肺炎生產(chǎn)的小分子藥物治療Omicron感染患者的臨床研究結(jié)果的同行評(píng)審報(bào)告
本次試驗(yàn)共納入136例非重癥新冠肺炎住院患者,其中60例在標(biāo)準(zhǔn)治療基礎(chǔ)上接受VV116治療,76例未接受VV116治療數(shù)據(jù)提示,在使用VV116的奧米克隆感染者中,從開始用藥到核酸轉(zhuǎn)陰的平均天數(shù)為3.52天,在首次核酸檢測陽性后5天內(nèi)使用VV116的患者中,從首次核酸檢測到陰性的平均時(shí)間為8.56天,短于對(duì)照組
據(jù)知情人透露,本次研究的對(duì)照組可能使用的是帕昔洛韋或中藥,比VV116和帕昔洛韋頭對(duì)頭試驗(yàn)開展的更早這種臨床試驗(yàn)在一定意義上類似于預(yù)實(shí)驗(yàn),為后來的大規(guī)模臨床試驗(yàn)提供指導(dǎo)事實(shí)上,VV116頭對(duì)頭帕昔洛韋的臨床試驗(yàn)方案已經(jīng)在該研究基礎(chǔ)上進(jìn)行了改進(jìn),首日劑量從300mg BID擴(kuò)大到600mg BID
作為新冠肺炎發(fā)展最快的口服藥物之一,VV116被寄予厚望據(jù)介紹,VV116在烏茲別克斯坦的售價(jià)為185美元,約合人民幣1248元,在中國,VV116的商品名是敏得威目前,VV116頭對(duì)頭臨床試驗(yàn)已經(jīng)完成,機(jī)構(gòu)預(yù)計(jì)經(jīng)過28天的臨床試驗(yàn)數(shù)據(jù),有望在不久的將來揭示盲性
除了君實(shí)生物的VV116,real bio的阿夫定和醫(yī)藥行業(yè)先鋒Procuramide的研發(fā)也走在了前面最終,誰能問鼎國內(nèi)新冠肺炎口腔醫(yī)學(xué)的頭把交椅,是目前外界最關(guān)心的問題
關(guān)于相關(guān)進(jìn)展,5月19日,君實(shí)生物在投資者互動(dòng)平臺(tái)上表示,公司正在全力加快VV116的研發(fā)進(jìn)度,與藥品監(jiān)管機(jī)構(gòu)保持積極溝通,爭取盡快提交在國內(nèi)的上市申請(qǐng)。
當(dāng)天,首創(chuàng)藥業(yè)相關(guān)人士告訴我們,目前,我們正在積極推進(jìn)向中國,美國等國家和地區(qū)的國家藥監(jiān)機(jī)構(gòu)申請(qǐng)緊急用藥EUA許可相關(guān)工作正在全力推進(jìn)
真人告訴我們不方便透露相關(guān)信息事實(shí)上,真實(shí)生物阿夫定最早完成三期臨床試驗(yàn),有時(shí)間優(yōu)勢,但至今沒有臨床數(shù)據(jù)公開
由于新冠肺炎三種國產(chǎn)口服藥物已經(jīng)完成或即將完成相關(guān)臨床試驗(yàn),能否獲批將取決于臨床數(shù)據(jù),上市越早,市場份額可能越大。
但是,這并不意味著后來者沒有機(jī)會(huì)根據(jù)我們的統(tǒng)計(jì),目前第一梯隊(duì)之外還有10多個(gè)新冠肺炎口服藥物處于研發(fā)階段,后來者的數(shù)量還在不斷增加
5月18日晚間,亞圣醫(yī)藥發(fā)布公告稱,核心品種奧瑞替尼具有治療新冠肺炎的潛力這意味著國內(nèi)R&D口腔醫(yī)藥企業(yè)在新冠肺炎又增加了一支新軍
亞圣藥業(yè)表示,最新的臨床前研究發(fā)現(xiàn),奧瑞替尼可有效抑制新冠肺炎變異株奧米克隆誘導(dǎo)的人外周血單個(gè)核細(xì)胞細(xì)胞因子風(fēng)暴,提示奧瑞替尼具有治療新型冠狀病毒,尤其是中重度患者的潛力這項(xiàng)研究成果當(dāng)天發(fā)表在歐洲分子生物學(xué)組織的頂級(jí)期刊《EMBO分子醫(yī)學(xué)》上
據(jù)報(bào)道,大多數(shù)新冠肺炎患者只有輕至中度癥狀,但仍有15%—20%的患者存在因大量細(xì)胞因子產(chǎn)生而導(dǎo)致的過度炎癥,即細(xì)胞因子風(fēng)暴,最終導(dǎo)致肺泡損傷和呼吸衰竭因此,尋找能夠抑制細(xì)胞因子釋放的潛在治療方法對(duì)于中重度新冠肺炎患者的治療非常重要
目前,JAK抑制劑巴里替尼已被FDA正式批準(zhǔn)用于新冠肺炎住院患者的治療,并被納入世衛(wèi)組織治療計(jì)劃,用于治療炎癥風(fēng)暴在這項(xiàng)研究中,與泊那替尼和巴里替尼相比,奧瑞替尼對(duì)奧米克龍—NTD介導(dǎo)的細(xì)胞因子釋放表現(xiàn)出更強(qiáng)的抑制作用,有望為中重度新冠肺炎患者提供一種新的治療選擇
新冠肺炎口服藥物研發(fā)領(lǐng)域的另一個(gè)現(xiàn)象是,臨床審批速度大幅提高。
比如simcere的SIM0417,今年3月首次獲批臨床應(yīng)用,4月初開始臨床應(yīng)用日前,Clinicaltrials.gov顯示,simcere開始了SIM0417聯(lián)合利托那韋治療輕中度新冠肺炎成年患者的II/III期臨床應(yīng)用幾天后,5月16日,simcere再次宣布,SIM0417已獲得美國食品藥品監(jiān)督管理局的臨床批準(zhǔn),擬用于接觸后預(yù)防和治療接觸過新冠試驗(yàn)陽性感染的密切接觸者這是中國第一個(gè)獲準(zhǔn)進(jìn)行暴露后預(yù)防臨床試驗(yàn)的新冠肺炎候選藥物
比如眾生藥業(yè)的RAY1216,5月11日公告,接受Ray1216片臨床試驗(yàn)申請(qǐng)日前,眾生藥業(yè)宣布RAY1216片獲得臨床批準(zhǔn)從受理到批準(zhǔn)臨床研究,只需要幾天時(shí)間,可謂迅速
R&D提速的背后,是相關(guān)部門的緊急審批據(jù)《光明日?qǐng)?bào)》17日?qǐng)?bào)道,國家美國食品藥品監(jiān)督管理局全力開展疫情期間應(yīng)急審評(píng)審批工作,組織制定了新冠肺炎治療藥物研發(fā)3項(xiàng)技術(shù)指南,批準(zhǔn)了新冠肺炎治療藥物臨床試驗(yàn)申請(qǐng)58項(xiàng),批準(zhǔn)清肺排毒顆粒,化濕敗毒顆粒,宣肺敗毒顆粒注冊(cè)上市
日前,科技部發(fā)布了《新型冠狀病毒藥物R&D應(yīng)急項(xiàng)目2022年度申報(bào)指南》的通知通知,項(xiàng)目重點(diǎn)研究小分子藥物和大分子藥物研發(fā)的應(yīng)急需求,具有成熟的臨床前有效性和安全性研究基礎(chǔ),產(chǎn)業(yè)化轉(zhuǎn)化成功率高,能夠快速進(jìn)入或推進(jìn)臨床研究根據(jù)新冠肺炎疫情防控的特殊要求,科技部將擇優(yōu)支持
但伴隨著上海疫情的穩(wěn)定,臨床試驗(yàn)使用的患者數(shù)量會(huì)逐漸減少,給后期的臨床試驗(yàn)帶來時(shí)間和挑戰(zhàn),可能還是要出國進(jìn)行臨床試驗(yàn),這樣的話費(fèi)用會(huì)大大增加。
6個(gè)創(chuàng)新藥物項(xiàng)目首次獲得臨床批準(zhǔn)。
在新的發(fā)布周期中,四環(huán)藥業(yè),全新生物,眾生藥業(yè),齊魯制藥6個(gè)創(chuàng)新藥項(xiàng)目首次獲得臨床批準(zhǔn),我們將其納入人民金融創(chuàng)新藥指數(shù)。
其中,瑞奇制藥有限公司的QR060127被批準(zhǔn)用于成人的慢性疼痛和炎癥性疼痛根據(jù)消息顯示,目前世界上市場上還沒有TRPC5拮抗劑目前只有兩種TRPC5拮抗劑處于臨床研究階段,進(jìn)展最快的是金翅雀生物公司研發(fā)的GFB—887,處于臨床II期TRPC5拮抗劑的臨床適應(yīng)癥包括FSGS,抑郁,焦慮等,但尚未發(fā)現(xiàn)與疼痛相關(guān)的適應(yīng)癥QR060127是國內(nèi)首個(gè)臨床申報(bào)的TRPC5拮抗劑,在國際上首次申報(bào)炎癥性疼痛的適應(yīng)癥有望為疼痛相關(guān)疾病提供一種新的臨床治療選擇
明生物的IO—108注射液于5月13日獲得臨床試驗(yàn)批準(zhǔn),用于晚期或轉(zhuǎn)移性實(shí)體瘤據(jù)介紹,IO—108是一種全新的抑制性抗體,針對(duì)髓系細(xì)胞免疫檢查點(diǎn)的白細(xì)胞免疫球蛋白樣受體B2這是中國第一個(gè)獲得臨床批準(zhǔn)的LILRB2抗體,也是益銘生物在全球獲得的第四個(gè)臨床批準(zhǔn)目前,IO—108正在美國進(jìn)行一期臨床試驗(yàn),以包括晚期實(shí)體腫瘤患者
另外,此次獲得臨床批文的QLS31904是齊魯制藥自主研發(fā)的靶向DLL3/CD3的雙特異性抗體目前國內(nèi)只有安進(jìn)的同靶點(diǎn)藥物進(jìn)入臨床,全信生物的QX008N注射液是我國臨床批準(zhǔn)的第三個(gè)TSLP單克隆抗體,四環(huán)藥業(yè)的XZB—0004膠囊是一種高活性,高選擇性的AXL靶向抑制劑
臨床進(jìn)展方面,近期,除了SIM0417聯(lián)合利托那韋在simcere進(jìn)行輕中度新冠肺炎成人的II/III期臨床試驗(yàn)外,智象醫(yī)藥的GR1802也進(jìn)入了II期臨床階段最近,該公司推出了一項(xiàng)關(guān)于GR1802治療中重度哮喘患者的療效和安全性的隨機(jī),雙盲,安慰劑對(duì)照和多中心臨床試驗(yàn)這些新成分的納入和R&D的推進(jìn)是人民金融創(chuàng)新藥物指數(shù)上升的主要原因
。鄭重聲明:此文內(nèi)容為本網(wǎng)站轉(zhuǎn)載企業(yè)宣傳資訊,目的在于傳播更多信息,與本站立場無關(guān)。僅供讀者參考,并請(qǐng)自行核實(shí)相關(guān)內(nèi)容。

2023年2月15日,湯臣倍健與美團(tuán)買藥在北京舉辦了2023

2021年收入增長目標(biāo)應(yīng)能確保實(shí)現(xiàn),2022年收入增長預(yù)計(jì)將

具體來看,一是簡化業(yè)務(wù)流程和材料,便利北京冬奧會(huì)相關(guān)區(qū)域內(nèi)境

炒股就看金麒麟分析師研報(bào),權(quán)威,專業(yè),及時(shí),全面,助您挖掘潛

,據(jù)索尼官方消息,新星粉,銀河紫,星光藍(lán),三款全新配色Dua

,新氧數(shù)據(jù)顏究院發(fā)布《2021醫(yī)美行業(yè)白皮書》,白皮書顯示,